Radioatividade
Aspectos Históricos
A geologia tornou-se uma ciência distinta da física e da química quando se observou a correlação de idade entre rochas, particularmente entre os séculos XVIII e XIX, no período em que gradualmente a escala de tempo geológica começou a ser estabelecida. Os primeiros passos em direção à geocronologia moderna veio com a descoberta do raio-X por W. C. Rontgen em 1895 e da radioatividade natural do urânio por H. Becquerel em 1896 e nos anos seguintes quando a comunidade de físicos e químicos estabeleceram rápido progresso na compreensão destes fenômenos.
Os anos seguintes a estas descobertas houve uma rápida evolução do conhecimento de vários aspectos da radioatividade e da sua aplicação no estudo da idade da terra. Esta indelicada questão sobre a idade do planeta (Figura 1) no qual vivemos foi causa de controvérsias científicas por muitos séculos. Remonta a Xenóphanes (570 a 480 a.c.) a primeira tentativa da medida do tempo geológico pela simples observação das mudanças da fauna encontradas em sedimentos; mais tarde, Heródoto (484 a 424 a.c) teceu considerações entre a duração do tempo pré-histórico e a espessura dos sedimentos depositados pelo rio Nilo. Apesar de religiosos e filósofos em vários momentos da civilização terem desenvolvido noções a respeito da história da terra, esse assunto não se tornou parte das discussões científicas até a geologia se tornar um campo independente de estudo. Anteriormente a 1750 a visão oficial era de que todas as rochas sedimentares teriam sido depositadas durante o Dilúvio. Entre essas postulações, pode-se citar as noções sobre o tempo da Terra proclamada na Inglaterra pelo Bispo Ussher em 1650, onde a criação do mundo teve lugar no ano de 4004 a.c.
O crescimento dos conhecimentos geológicos associados com o trabalho de James Hutton enfatizou a importância de processos lentos e contínuos para formação das formas observadas na superfície da Terra. A proposta desenvolvida por Hutton em seu livro Teory of the Earth, publicado em 1785 onde foi definido o conceito de Unifornitarismo, estabeleceu um conflito com a idéia até então aceita definida como Catastrofismo. Esta nova proposta foi rejeitada pela comunidade religiosa de então e só passou a ser aceita com os trabalhos de geólogos posteriores daquela época que confirmaram o princípio de uniformitarismo.
Desta forma, tornou-se comum a convicção de que longos períodos de tempo são necessários para deposição de rochas sedimentares com espessuras de vários kilômetros. A geologia estava emergindo como uma ciência solidamente baseada em evidências cuja interpretação apoiava o uniformitarismo. Uma nova geração de geólogos substituiu as velhas gerações como no caso de Charles Lyell que publicou em 1930 seu primeiro volume de Principles of Geology, o que permitiu nos meados do século XIX que os geólogos desenvolvessem novas pesquisas a partir da certeza de uma terra mais velha.
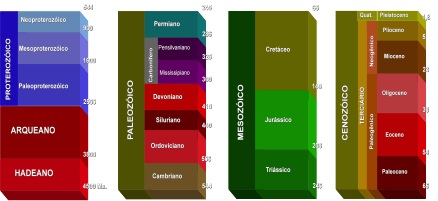
Figura 1. As divisões do tempo geológico no Planeta Terra.
A aparente antigüidade da Terra e o princípio de uniformitarismo foram atacados por Lord Kelvin através da publicação, entre 1862 e 1899, de trabalhos onde eram estabelecidos limites sobre a possível idade antiga de Terra. Os cálculos de Lord Kelvin eram baseados em considerações sobre a luminosidade do sol, a história de resfriamento da Terra e os efeitos das fases lunares sobre a taxa de rotação da Terra. Ele inicialmente concluiu que a Terra não poderia ser mais velha do que 100 Ma, limitando sua idade em um período entre 20 e 40 Ma e causando um embaraço no progresso do conhecimento geológico através argumentos que pareciam irrefutáveis. Da mesma forma G. H. Darwin (1877) estimou uma idade mínima pra a Terra de 57 Ma, baseado em cálculos sobre a separação da Lua e da Terra. Na mesma época Joly (1900), trabalhando com valores sobre a taxa de salinização dos oceanos, chegou a números (entre 89 e 90 Ma) bastante semelhantes aos de Lord Kelvin.
Contrastando com os dados anteriores, James Hutton e colaboradores, com base na taxa de sedimentação considerava que cerca de 33 cm de arenito se depositava em 1500 anos, 33 cm de argilito em 3000 anos e 33 cm de calcário em 25000 anos e sugeria uma cifra de 700 Ma como o tempo transcorrido desde o Cambriano. Foi H.S. Willians em 1893 que introduziu o termo geocronologia, o qual tinha como padrão o período de tempo Eoceno (aproximadamente 20 Ma), propondo também cifras de várias centenas de milhões de anos desde o Cambriano.
Ironicamente o trabalho de Lord Kelvin intitulada “The Age of the Earth an Abode Fitted for Life’’ foi publicado em 1897, um ano após a descoberta da radioatividade anunciada pelo físico francês Henri Becquerel. Poucos anos depois foi reconhecido que a desintegração de elementos radioativos é um processo exotérmico e que a história de resfriamento da terra deveria levar em conta o aquecimento produzido pela radioatividade natural ao contrário do proposto por Lord Kelvin.
A radioatividade
Devemos a Marie e Pierre Curie (1898) a denominação da radioatividade. Embora esse fenômeno tivesse sido descoberto antes (1895) pelo alemão W. C. Roentgen que o definiu como sendo a emissão de radiações capazes de atravessar corpos opacos através de experimentos sobre luminescência utilizando-se um tubo de raio catodo energizado. Porém foi Henrie Becquerel (1896) que, trabalhando com sais de urânio, analisou os efeitos das radiações na ausência de luz, sistematizou e ordenou os primeiros experimentos sobre a radioatividade.
A radioatividade pode ser definida como a variação nuclear espontânea, caracterizada pela emissão de radiações eletromagnéticas ou partículas, ocasionando a transformação de um nuclídeo em outro. Ela não pode ser vista, sentida, ouvida diretamente e é detectável somente com o auxílio de aparelhos mecânicos ou eletrônicos. Entre os principais efeitos que as radiações podem provocar, pode-se citar a impressão de chapas ou emulsões fotográficas, fluorescências de materiais como a fluorita e a ionização de gases e liberação de energia ao atravessarem corpos. As partículas descobertas (Alfa e Beta) e a radiação eletromagnética que foram caracterizadas posteriormente por vários pesquisadores como Rutherford, Soddy e Bohr explicam agora facilmente o enigma dos tempos de Kelvin. A radioatividade é responsável não só pelo calor primordial da Terra, mas também pelas principais fontes de calor que ainda hoje emanam junto a superfície terrestre.
A descoberta de elementos radioativos passou a ser objetivo de vários pesquisadores após a descoberta da radioatividade, como o exemplo de Marie e Pierre Curie que, através do estudo de minérios de urânio, identificaram em 1898 dois novos elementos os quais nomearam polônio e rádio. Enquanto isso Rutherford relatava (1899) que a radiação emitida por substâncias radioativas consiste de três diferentes componentes por ele denominados de Alfa, Beta e Gama. O componente Alfa consistia de um núcleo de hélio enquanto as emissões Beta eram identificadas como elétrons. Somente os raios Gama demonstravam ser radiação eletromagnética similar aos raios-X descoberto por Roentgen. Os trabalhos conjuntos de Soddy e Rutherford sobre compostos de tório radioativo os levaram a formular a teoria do decaimento e crescimento radioativo. Eles sugeriram que os átomos de elementos radioativos formavam espontaneamente átomos de um outro elemento. Eles propuseram que a desintegração era acompanhada pelas emissão de partículas Alfa e Beta e que a intensidade da radiação é proporcional ao número de átomos radioativos presentes.
Uma importante contribuição de Rutherford foi resultado o seu famoso experimento sobre partículas Alfa. Os resultados desse experimento indicaram que átomos têm núcleos muito pequenos carregados positivamente e que esse núcleo é envolvido por elétrons. A carga positiva do núcleo foi atribuída a presença de prótons, tal qual o próprio Rutherford havia previsto em 1919. Um ano depois ele especulou que o núcleo do átomo poderia conter uma partícula neutra cuja confirmação veio a ser demonstrada posteriormente. O modelo de átomo de Rotheford não teve vida longa quando Niels Bohr aplicou princípios de mecânica quântica no estudo do átomo de hidrogênio e postulou que os elétrons apresentam diferentes estados de energia. A teoria de Niels Bohr permitia explicar o espectro do hidrogênio mas falhava quando aplicado a átomos com mais elétrons, como ficou demonstrado no estudo da série de decaimento do urânio. Em seqüência a estas descobertas, determinações mais precisas realizadas por T. W. Richards mostraram que os pesos atômicos dos elementos não são números inteiros e que o Pb, o elemento estudado por este cientista, produzido pelo decaimento do urânio tinha diferentes pesos atômicos quando comparado com o Pb comum. Esse problema foi resolvido pela brilhante sugestão feita por Soddy de que o lugar ocupado por um elemento na tabela periódica poderia acomodar mais do que uma espécie de átomo. Ele chamou esses átomos de isótopos o qual em grego significa ’’mesmo lugar’’. Como decorrência desta descoberta pode-se afirmar definitivamente que o peso atômico de um elemento representa um peso médio de uma mistura de diferentes átomos.
O início da geocronologia
A rápida série de descobertas sobre as propriedades radioativas de alguns elementos permitiu uma melhor compreensão e caracterização das partículas sub-atômicas e a conseqüente aplicação destes conhecimentos na geologia. Como exemplo em 1898 Marie Curie descobre a atividade radioativa do tório. Em 1905 J. J. Thompson descobre a radioatividade do Rubídio e em 1906 Campbell e Wood acrescentam que o Potássio também e radioativo. A partir desta descoberta, Boltwood em 1907 apresenta uma aplicação do método urânio/chumbo na determinação de idades absolutas.
Remonta a 1905 a primeira datação geocronológica absoluta, efetuada por Rutherford através do decaimento do rádio para o hélio. Esse cientista estudou uma amostra de fergusonita com 7% de urânio e encontrou 1,8 cm3 de hélio. Tendo em conta a meia vida do urânio, Rutherford atribuiu àquele mineral a idade de 500 Ma, salientando contudo que provavelmente esta idade seria mais elevada pois teria havido perda de hélio por processos de difusão. Esse trabalho só foi possível a partir dos resultados obtidos por Bolt Wood (1907) que concluiu que o chumbo era o produto final do decaimento do urânio e poderia ser utilizado para estimar a idade dos minerais com urânio.
Outra importante contribuição foi realizada por A. Homes (1913) através da sua publicação ”The Age of the Earth’’ onde a partir da aplicação das três series de decaimento dos actinídeos, o autor estimou a duração dos eons Fanerozóicos e do período Pré-Cambriano. Já em 1917, Barrell pôs em um sofisticado contexto geológico as implicações dos novos dados U-Pb em rochas e sua versão da escala de tempo geológico para o Fanerozóico ainda permanece parcialmente aplicada até nos dias atuais.
Em 1923 o ’’National Research Council of the United States’’ cria o primeiro organismo destinado exclusivamente a medir o tempo geológico – ’’Committee on the Measurement of Geologic Time by Atomic Desintregration’’. Neste período Alfred O. Nier passa a se interessar por problemas de geocronologia e sobre a idade da Terra. Em colaboração com G. P. Baxter ele começa a medir a composição isotópica do chumbo e novos métodos de datação baseados no decaimento do urânio e do tório para o chumbo. Outra importante contribuição de Nier foi a construção de espectrômetros de massa que a partir da década de 50 passaram a ser construídos em série o que permitiu a construção de vários laboratórios e o fenomenal crescimento da geologia isotópica. Antes disso e desde 1905, grande número de determinações foram feitas, especialmente sobre minerais de urânio mas sempre sem a sistematicidade que hoje se imprime a este estudo, não passando pois estas determinações de simples ensaios de pesquisa e aperfeiçoamento de métodos e instrumentais envolvidos.
A estrutura interna dos átomos
Nosso conceito de estrutura interna do átomo sofreu uma evolução dramática desde que Rutherford pela primeira vez demonstrou a existência do núcleo, e de uma série de partículas subatômicas que estão sendo descobertas e caracterizadas ainda nos dias atuais. Entretanto será suficiente para o nosso propósito de aplicação dos conceitos da física nuclear para fins radiocronológicos a adoção de um modelo simplista de átomo. Desta forma podemos vislumbrar o átomo como um núcleo pequeno e positivamente carregado aonde a massa se concentre (Figura 2). Este núcleo é envolvido por uma nuvem de elétrons em movimento e em um átomo neutro as cargas negativas dos elétrons são balanceadas exatamente pelas cargas positivas do núcleo. O diâmetro dos átomos é da ordem de 10-8 cm e são convenientemente expressas em angstron (1 Å = 10-8 cm). O núcleo dos átomos são aproximadamente 10.000 vezes menores do que o seu diâmetro (na ordem de 10-12 cm ou 10-4Å). A densidade da matéria nuclear é de aproximadamente 1014 gramas por cm³ o que equivale ao inimaginável valor de 100 milhões de toneladas por cm³.
Atualmente é conhecida uma grande quantidade de partículas elementares presentes no núcleo que interagem entre si e são organizadas em padrões ainda não bem identificados pela ciência. Duas dessas partículas são importantes para o nosso estudo, o próton (p) e o nêutron (n) que juntos são responsáveis por praticamente toda a massa e carga presente no núcleo. Brevemente falando um próton é uma partícula tendo uma carga positiva de igual magnitude porém de diferente polaridade em relação a carga do elétron.
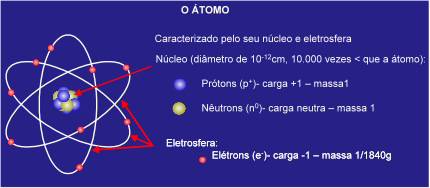
Figura 2. O átomo e seus constituintes internos
Nêutrons apresentam uma massa levemente maior do que os prótons e não apresentam carga elétrica. Neutrons extra nucleares são instáveis e decaem espontaneamente para formar prótons e elétrons com uma meia-vida de 10,6 minutos. Ainda de nosso interesse no interior do átomo, destaca-se a presença dos elétrons que envolvem o núcleo. Essas partículas apresentam massa inexpressiva (1/1836,1 quando comparado com o átomo de hidrogênio exemplificado na Figura 3 e Tabela 1) e uma carga elétrica negativa. Em um átomo neutro o número de elétrons é igual ao número de prótons. Conseqüentemente o número de prótons no núcleo de um átomo determina quantos elétrons devem existir para o átomo ser eletricamente neutro. O número de elétrons e sua distribuição ao redor do núcleo, por seu turno, determina as características químicas de um átomo.
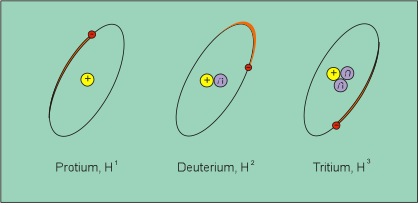
Figura 3. Os isótopos de hidrogênio.
| Massas das principais partículas subatômicas | |
| Partícula | Massa |
| Elétron | 9,1085 x 10-28 |
| Proton | 1,6724 x 10-24 |
| Neutron | 1,6724 x 10-24 |
Tabela 1. Massas das principais partículas sub-atômicas.
O processo de nucleossíntese
Uma das questões mais intrigantes sobre a matéria é sobre a sua origem no universo conhecido. Essa questão vem sendo parcialmente respondida através de sondagens de zonas externas ao nosso sistema solar e também por estudo comparativo entre os planetas desse sistema. Sabe-se que a massa distribui-se de forma heterogênea em diversas escalas do espaço.
Uma das postulações melhor aceita para explicar a geração da matéria é a teoria do Big Bang. De acordo com esta hipótese toda a matéria e energia conhecida se originou a partir de uma grande explosão de forma a que, no decorrer dos primeiros segundos, houve a estabilização de dois tipos de átomos: o He (com 88%) e H (com 12%). A partir da simples constatação da existência de átomos mais pesados percebe-se que a matéria como é hoje conhecida não foi formada somente pelo Big Bang. A geração de átomos maiores e mais pesados, que é o próprio conceito de nucleossíntese, ocorreu durante a evolução de corpos estelares. Nesse sentido, durante o processo de formação das estrelas supõe-se que a alta pressão e temperatura existente em seus núcleos tenha possibilitado a formação de átomos com massa (M) até 56 (ferro). Os elementos com M maior de 56 provavelmente foram gerados no final da vida de grandes estrelas que ao explodirem deram origem aos elementos de massa (M) até 269 (Figura 4).
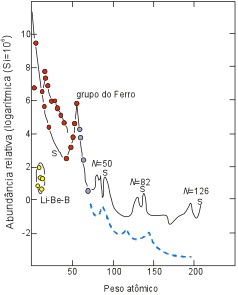
Figura 4. Abundância relativa dos elementos no Universo. Os elementos do grupo do Ferro são formados durante a evolução de uma estrela, com a queima de H e He. Os elementos de massa maior do que o Ferro são formados durante a explosão da Super Nova.
É razoável supor que a matéria presente na Terra tenha se originado durante a explosão de uma Super Nova cujos produtos tenham sido reaglutinados dando origem aos planetas do sistema solar. O processo de nucleossíntese é caracterizado por reações nucleares onde dois ou mais elementos são aglutinados para a formação de um elemento com N e Z maiores sem que a energia no interior das estrelas é suficiente apenas para a formação de elementos com N até 56 e a energia necessária para a formação de elementos com N maior de 56 apenas ocorre durante a explosão de uma Super Nova (Figura 5).
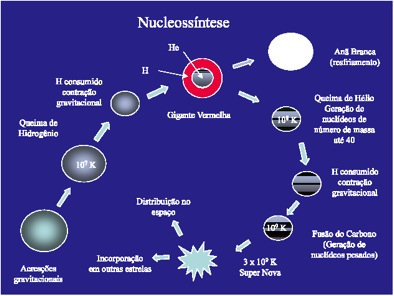
Figura 5. Evolução simplificada de uma estrela até a formação de uma Super Nova.
O processo de nucleossíntese pode ser compreendido como uma simples aglutinação de átomos que podem a partir da sua formação não serem estáveis, o que propicia o início do seu decaimento. Os métodos radiocronológicos objetivo deste texto são baseados nas propriedades destes átomos que sofrem decaimento espontâneo, conceito de radioatividade conforme definido por Marie e Pierre Curie. Desta forma a natureza da formação da matéria (nucleossíntese) do universo conhecido propiciou uma ferramenta de datação baseada no processo de decaimento radioativa escopo da geocronologia.
O processo de decaimento
É plausível admitir que existe uma relação entre a estabilidade de um núcleo de um átomo e sua abundância na natureza. Apenas cerca de 260 nuclídeos são estáveis entre os 1.700 conhecidos, evidenciando que a estabilidade nuclear é uma exceção e não uma regra.
O núcleo de um átomo instável sofre transformações espontâneas que envolvem a emissão de partículas e de energia. Existem diferentes caminhos pelos quais um átomo instável pode decair. Alguns átomos entretanto podem decair por duas ou três diferentes maneiras, mas na maioria dos casos os átomos decaem de uma única maneira. Em todos os casos o decaimento radioativo resulta em mudanças de Z e N e conseqüentemente provoca a mudança de um átomo de um elemento para o de um outro elemento. O novo átomo gerado pelo decaimento radioativo é denominado radiogênico (radio = radioatividade e gênico = originado). O isótopo radiogênico é também denominado de isótopo filho que pode, por sua vez, tornar a decair gerando neste segundo decaimento um terceiro isótopo. Esse processo pode se repetir até que seja gerado um átomo estável (Figura 6).
Os estudos efetuados por Rutherford e outros pesquisadores logo após a descoberta da radioatividade demonstraram que ela envolve a emissão de três diferentes tipos de raios que foram denominados de Alfa, Beta e Gama. Posteriormente descobriu-se um quarto tipo de decaimento envolvendo a captura de elétrons que resulta na emissão de uma partícula Beta a partir do núcleo. Os caminhos de decaimento encontrados pelos átomos para se tornarem estáveis são descritos a seguir.
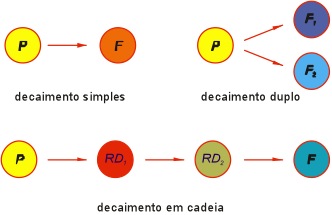
Figura 6. Formas de decaimento: simples, bifurcado e em cadeia.
• A partícula Alfa
A natureza corpuscular da partícula Alfa (Figura 7) foi evidenciada por Rutherford no começo deste século. É nada menos que o núcleo do átomo de hélio, de massa quatro (dois prótons e dois nêutrons, logo de carga +2).
A velocidade desta partícula varia de acordo com a sua energia e pode estar situada entre 14000 e 25000 km/s. É uma partícula monoenergética e ionizante que produz um par de íons para cada 35 Ev de energia. A sua penetração no ar e em outros materiais é variável de acordo com a sua energia. A partícula Alfa produzida pelo Ra, por exemplo, cuja energia é de 7,68 Mev e v = 19220 Km/s penetra cerca de 7 cm no ar em condições ambientais de temperatura e pressão. No alumínio e nas emulsões fotográficas a penetração é de cerca de 40um, enquanto que no chumbo apenas 14,1 um.
Um grande número de radionuclídeos decai pela emissão espontânea de partículas Alfa a partir de seus núcleos. Este modo de decaimento e possível para nuclídeos com Z = 58 (cério) ou maior e para alguns poucos nuclídeos de baixo número atômico incluindo He, Li e Be. A emissão de uma partícula Alfa reduz tanto o número atômico quanto o número de nêutrons em duas unidades e o número de massa em quatro unidades e resulta em um isótopo de um elemento diferente do elemento original.
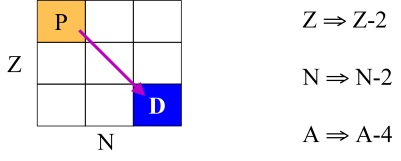
Figura 7. Decaimento Alfa.
• A partícula Beta
Um grande número de radionuclídeos decai pela emissão de uma partícula positiva (pósitron) originada do núcleo (partícula Beta). Este processo é relacionado com a transformação de um próton em um nêutron que é acompanhado pela emissão de um pósitron e um neutrino (Figura 8). Evidentemente o decaimento Beta resulta em um isóbaro que tem um próton a menos do que o elemento original.
Estas partículas são igualmente originárias do núcleo, fato este que as distingue dos elétrons convencionais. A partícula Beta(+) de existência bastante efêmera (T1/2=10-10 s) constitui-se na antipartíula mais simples conhecida. As partículas Beta(+) interagem com elétrons originando duas radiações de 0,511 MeV, cuja irradiação é definida como reação de aniquilação.
Quanto a partícula Beta(-), da mesma natureza dos elétrons orbitais, mas originaria do núcleo e portanto de difícil explicação, levou Fermi (1934) a postular a seguinte reação para explicar a sua emissão:
n → p + Beta(-) + u
As energias máximas variam bastante conforme o radionuclídeo emissor. Alguns exemplos típicos conhecidos são:
40K = 1,35 MeV
14C = 156 KeV
3H = 18,1 KeV
Entre os efeitos causados, podemos citar: ionização, excitação de freamento com emissão de raios-X , elétrons de conversão interna e criação de isômeros (núcleos em condições metaestáveis). O poder de penetração de partículas Beta varia de alguns centímetros a 13 metros (caso que é equivalente ao alumínio com densidade superficial de 1,57 g/cm3 ) dependendo da energia ou velocidade (v) comparada com a velocidade da luz (c).
Num decaimento Beta(-), o número atômico é aumentado de uma unidade enquanto o número de nêutrons é diminuído de uma unidade. Como o número de massa (Z + N = A) permanece o mesmo, temos como produto final um isóbaro. No decaimento de Beta(+), a diferença em relação ao processo anterior é relativa ao número atômico Z que é diminuído de uma unidade enquanto o número de nêutrons e aumentado de uma unidade.
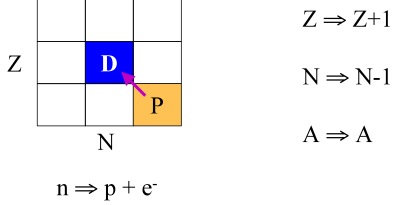
Figura 8. Decaimento Beta
• A partícula Gama
O decaimento Gama (Figura 9) ocorre pela emissão de radiações eletromagnéticas de comprimento de onda menor que 10-2Å de origem nuclear, o que as diferencia dos raios-X que são decorrentes de rearranjos de elétrons em orbitais e cujos comprimentos de onda estão entre 1,0 e 2,0 Å. Por emissão Gama o núcleo é levado a um estado intermediário ou fundamental e atinge o estado fundamental, geralmente após uma outra transmutação.
Por serem destituídos de massa são as mais penetrantes, necessitando por isso de blindagem, normalmente de chumbo, para conter os seus efeitos.
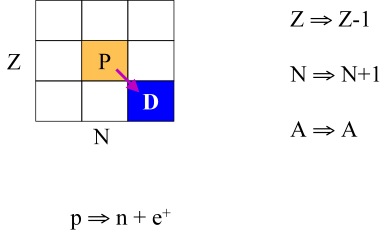
Figura 9. Decaimento Gama
• Decaimento por Captura de elétron
O processo de captura de elétron (Figura 10) verifica-se em elementos com deficiência de nêutrons onde um elétron da camada K ou L é capturado ocorrendo a seguinte reação nuclear:
p + e- → n + u (monoenergético)
Com a diminuição de um próton e o aumento de um nêutron o processo em questão é pois equivalente ao de uma emissão Beta(+). Se o núcleo resultante dessa captura ficar num estado excitado, o mesmo poderá decair para o seu estado fundamental mediante emissão de uma radiação Gama, e como exemplo típico, pode-se citar o caso do 40K que decai para o 40Ar. A captura de elétrons é um mecanismo pelo qual um núcleo pode diminuir seu número de prótons e aumentar seu número de nêutrons capturando um de seus elétrons. A probabilidade de captura é maior para os elétrons do orbital K, em função da sua proximidade do núcleo, entretanto elétrons dos orbitais L e M também podem ser capturados. A remoção de um elétron do orbital K ou de outros orbitais de maior energia acarreta a vacância que é subseqüentemente preenchida por outro elétron (vindo de uma camada energeticamente superior) que preenche a posição. Nesse processo esses elétrons emitem uma série de raios-X que podem ser detectados.
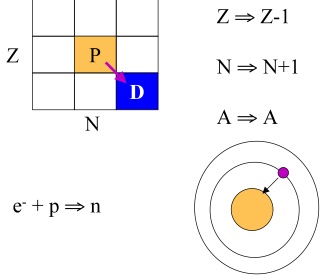
Figura 10. Decaimento por captura de elétron.
Leis do decaimento radioativo
As teorias e as leis da desintegração radioativa foram basicamente estabelecidas por Rutherford & Soddy (1902). Segundo essa teoria, a taxa de decaimento de um átomo instável é proporcional ao número de átomos restantes a qualquer tempo t (Figura 11). Transformando esta regra em linguajar matemático obtém-se :
![]()
Figura 11. Equação fundamental da geocronologia.
Considerando que um grande número N de átomos radioativos de uma mesma espécie tende a se desintegrar numa unidade de tempo t, a velocidade de desintegração é denominada de constante lambda (l). Sabe-se que essa constante é muito pouco influenciada por parâmetros como temperatura, pressão ou tipo de ligações químicas e que esta influência é muito menor do que a precisão das medidas radiométricas. Pode-se assim admitir que o relógio radiométrico tem uma velocidade constante, independentemente das condições geológicas (Figura 12).
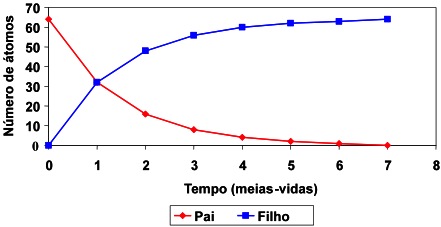
Figura 12. Curvas de decaimento de isótopo radioativo para o radiogênico.
A proporcionalidade expressa acima é transformada em igualdade pela introdução da constante l a qual é também denominada de constante de decaimento (Figura 13). O valor numérico de l é característico de um radionuclídeo em particular e representa a probabilidade que um átomo decairá dentro de um espaço de tempo. A equação fundamental da geocronologia expressa um dado número de átomos radioativos (N) restante após um período de decaimento (t). A velocidade de decaimento radioativo de um isótopo particular pode ser expressa, além da constante l, pela sua meia-vida (T1/2). A meia-vida (Figura 14 ) é definida como o tempo necessário para que o número de átomos originais seja reduzido à sua metade.
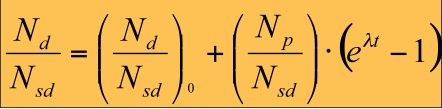
Figura 13. Equações do decaimento para o isótopo pai (p) e filho (d).
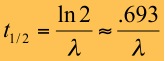
Figura 14. Equação da meia-vida de um radionuclídeo.
A definição de pares de isótopos para a aplicação em geocronologia depende fundamentalmente dos aspectos de (i) compatibilidade da meia vida e o período de tempo do processo geológico a ser estudado; (ii) existência dos isótopos de interesse em concentrações mensuráveis (acima do teor de detecção) em rochas ou minerais; e (iii) o desenvolvimento de procedimentos laboratoriais para a quantificação das concentrações dos isótopos de interesse. Na Tabela 2 estão listados os pares de isótopos aplicados na geocronologia que atenderam aos três aspectos citados.
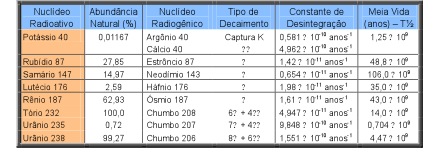
Tabela 2. Nuclídeos radioativos de meia-vida longa utilizados em geocronologia.

