Diluição isotópica
Os métodos geocronológicos foram descobertos e sofreram modificações acompanhando a evolução do conhecimento e o desenvolvimento de equipamentos mais precisos e novas técnicas laboratoriais. Desta forma, a evolução dos procedimentos analíticos para fins de datação tiveram modificações que acompanharam o conhecimento e os equipamentos disponíveis em um dado período.
A classificação dos métodos geocronológicos (método que direta ou indiretamente contribui para a obtenção de uma idade isotópica) pode ser feita em função do tipo de instrumental envolvido. Os principais métodos segundo o modo de análise são: métodos químicos e métodos físicos.
O desenvolvimento dos métodos físicos pode ser dividido nos método por decaimento e por acumulação. Os métodos por decaimento levam em conta a curva de decaimento do elemento radioativo com a utilização de espectrômetros Alfa ou Beta e o que se mede é a quantidade de radionuclídeo remanescente na amostra. Neste caso os exemplos citáveis são o radiocarbono ou 14C e o método do desequilíbrio do urânio, entre outros. Em todos esses métodos, por envolverem radionuclídeos de meia-vida menores do que cerca de 250.000 anos, o seu alcance é restrito para valores da ordem de 1 Ma ou menores.
Os métodos de acumulação, por sua vez, são baseados na determinação da quantidade de nuclídeos radiogênicos acumulados. Estes métodos dependem da utilização da espectometria de massa o que só veio a se tornar comum nos laboratórios de geocronologia a partir da década de 1930, após a publicação de Chastagner (1913) envolvendo análises de Pb e outros elementos. Esses métodos levam em conta as constantes de decaimento dos respectivos isótopos radioativos. Entre eles pode-se citar o K-Ar, K-Ca, Rb-Sr, U-Pb, Th-Pb, Pb-Pb, Sm-Nd, Re-Os e Lu-Hf.
A aplicação da técnica de diluição isotópica para cada um destes decaimentos pode ser encontrada em trabalhos publicados nos períodos iniciais do desenvolvimento dos respectivos métodos geocronológicos. Como exemplo pode-se citar Long (1966), Boelrijk (1968), Krough e Hurley (1968), Dodson (1970), Gale (1970), Russel (1971, 1977), Faure e Powel (1972), Cummings (1973), Moore et al., (1973), Wasserburg et al. (1981), Hamelin et al., (1985), Powel et al., (1998), Galer (1999) e Thirlwall (2000). No Brasil a técnica foi descrita de forma mais completa no trabalho de Kawashita e Torquato (1991).
Procedimentos analíticos
Os procedimentos analíticos desenvolvidos a partir da utilização da espectometria de massa necessitam utilizar a diluição isotópica de forma a se obter medidas quantitativas dos isótopos de interesse. Desta forma a introdução da diluição isotópica veio permitir que além das razões isotópicas, informações sobre a abundância real de um ou mais isótopos de um composto químico ou elemento isolado.
A técnica da diluição isotópica baseia-se na adição de uma certa quantidade, rigorosamente conhecida, de um traçador ou spike de abundância isotópica totalmente diferente da abundância isotópica do elemento a medir, em uma quantidade igualmente conhecida do composto químico ou elemento que se pretende determinar a abundância. A técnica é um processo analítico muito sensível que tem a particularidade única de uma vez feita a mistura, qualquer alíquota representativa da mesma ser suficiente para uma determinação quantitativa com precisão geralmente melhor que 0,5%.
Uma maneira prática de ver o funcionamento desta técnica é imaginar um recipiente cheio de feijões pretos em quantidade desconhecida (Figura 28). Se nele for adicionado um numero rigorosamente conhecido de feijões brancos e homogeneizada a mistura, basta retirar uma alíquota da mistura, contar os feijões brancos e pretos presentes e, a partir do número inicial de feijões brancos, uma simples regra de três permite calcular o número de feijões pretos.
A utilização da diluição isotópica em estudos nucleares e isotópicos se tornou praticamente universal nas décadas de 1970 e 1980 por se mostrar uma ferramenta extremamente pratica e única em vários campos de aplicação analítica entre eles a geocronologia. O volume ideal de traçador a ser diluído na amostra desconhecida corresponde ao valor em moles na proporção 1:1 em relação com a quantidade em moles da amostra desconhecida. Como este segundo valor é desconhecido, a quantidade de traçador é definida por estimativa, sendo que se esta estimativa estiver errada, os procedimentos devem ser repetidos para aproximar o valor em moles do traçador com a amostra desconhecida. Na Figura 29 observa-se que os resultados finais tem errpos menores quando a estimativa do traçador é correta.

Figura 1.
Visualização do princípio da diluição isotópica com o balde de feijões. Na técnica de diluição isotópica depois de adicionado o traçador à amostra desconhecida, qualquer alíquota desta solução pode ser utilizada para se descobrir a concentração do elemento de interesse.
Procedimento típico da diluição isotópica
Os passos iniciais da diluição isotópica deve levar em conta a necessidade, a patir de um certo momento, de um espectrômetro de massa. Os procedimentos podem ser assim resumidos:
Passo 1: Uma porção da amostra a ser analisada é dissolvida em solvente apropriado. Por vezes, no caso de silicatos, é necessário fazer uso de etapas de solubilização (com ácido fluorídrico) para se obter a dissolução completa.
Passo 2: Uma quantidade bem conhecida de um traçador (um isótopo do elemento em questão) é diluída ao resultado da etapa 1.
Passo 3: A mistura (amostra + traçador) é homogeneizada.
Passo 4: O elemento de interesse é extraído quimicamente através do uso de colunas de troca iônica com o objetivo de se evitar isóbaros interferentes de outros elementos.
Passo 5: Determinam-se, com o espectrômetro de massa, as razões isotópicas do elemento em estudo. A composição isotópica obtida nesta última etapa permite o cálculo da concentração do elemento da amostra original.
Em princípio a técnica de diluição isotópica só pode ser utilizada para elementos que apresentem mais de um isótopo com é o caso do urânio. No entanto, no caso de elementos monoisotópicos, pode-se obter um segundo artificialmente através do uso de reatores nucleares.
Vantagens e desvantagens da diluição isotópica
A principal vantagem da técnica da diluição isotópica é por ela ser absoluta e não requerer calibração com amostras de concentração conhecidas. Se a concentração do traçador for calibrada usando o mesmo espectrômetro que será utilizado nas medidas das misturas, a discriminação do aparelho será cancelada uma vez pode ser considerada igual.
Outro aspecto vantajoso desta técnica é que qualquer tipo de espectrômetro de massa pode ser utilizado uma vez que a técnica envolve apenas razões isotópicas. Em adição, se o traçador tiver a qualidade de ter composição isotópica bastante diferente da amostra a ser analisada, a acuracidade da análise é maior.
Em contrapartida a técnica apresenta a desvantagem de exigir todos os procedimentos analíticos apenas para alguns elementos de cada vez. Outras desvantagens da técnica é a sua sensibilidade aos problemas de contaminação e o número limitado de elementos passíveis de serem analisados por esta técnica.
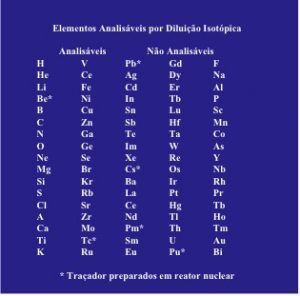
Tabela 1. Elementos analisáveis por diluição isotópica.
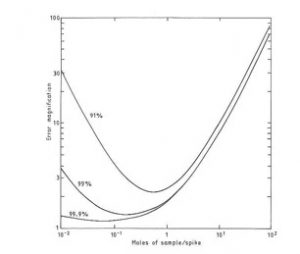
Figura 2.
Diagrama mostrando a otimização da quantidade de traçador a ser utilizado em uma análise por diluição isotópica.
Tipos de traçadores
Praticamente todos os isótopos aplicáveis na geocronologia são disponíveis comercialmente. No caso de elementos polisotópicos como Sr, Sn, Pb e Nd são disponíveis vários isótopos desses elementos e com diferentes graus de enriquecimento que podem ser utilizados como traçadores. O melhor traçador é aquele que apresenta composição isotópica o mais diferente possível em relação aos isótopos presentes na amostra a ser analisada . Embora seja possível obter alguns traçadores com estas características, como no caso do Th, Pb e U que são de interesse na geocronologia, existem algumas restrições relativas a disponibilidade e custo. Assim a escolha do traçador deve ser considerada em termos de restrições e outras particularidades como interferências isobáricas e possíveis dificuldades nas correções devidas ao fracionamento isotópico.
 Tabela 2.
Tabela 2.
Traçadores disponíveis (comercialmente, com valores sujeitos a variações) para o desenvolvimento de análises por diluição isotópica.
Referencias
Aston, W.L. 1919 A positive Ray spectrograph. Phil. Mag., ser 6(38):707-714.
Becquerel, H. 1896 Sur les radiations invisibles emises par phosphorescence. Compt. Rend. Acad. Sci. Paris., 122:420-421.
Boelrijk, N.A.I.M.1968 A general formula for doublé isotope dilution analysis. Chemical Geology 3:323-325.
Boltwood, B.B. 1907 On the ultimate desintegration products of the radio-active elements. Part II. The desintegration products of the uranium. Am. J. Sci. 173:77-88.
Bohr N. and Wheeler, J.A. 1939 The mechanismm of nuclear fission. Phys. Ver., 5:426-450.
Campbell, N.R. e Wood, A. 1906 The radioactivity of the alkali metals. Proceedings of the Cambridge Philosophical Society 14:15-21.
Cummings, G.L. 1973 Propagation of experimental erros in lead iaotope ratio measurements using doublé spike method. Chemical Geology 11:157-165.
Curie M. e Curie P. 1898 Sur une substance nouvelle radio-active, contenue dans la pechblende. Comptes Rendus de l’ Academie Scientifique de Paris 127:175-178.
Dodson, M.H. 1970 Simplied equations for doublé-spiked isotopes analysis. Geochimica et Cosmochimica Acta, 34:1241-1244.
Duckworth, H.E. 1958 Mass spectrometry. Cambridge University Press. 206p.
Faure, G. e Powel, J.L. 1972 Strontium isotope geology. Springer-Verlag. Berlin-Heilderberg. e New York 188p.
Gale, N.H. 1970 A solution in closed form for lead isotope analysis using a doublé spike. Chemical Geology 6:305-310.
Galer, S.J.G. 1999 Optimal doublé and triple spiking for high precision lead isotopic measurement. Chemical Geology 157:255-274.
Hamelin, B., Manhès, G., Albarède, F. e Allègre, C.J. 1985 Precise lead isotope measurements by the doublé spike technique: a reconsideration. Geochimica et Cosmochimica Acta 49:173-182.
Hutton J. 1785 Theory of the Earth
Joly, J. 1900 Na estimate of the age of the Earth. Scientific Transactions of the Royal Dublin Society, Ser 2, 7:23-266.
Kawashita, K. e Torquato, J.R. 1991 Geocronologia Nuclear II: Métodos geocronológicos: Técnicas de medida espectrógrafos e espectrômetros. Revista de Geologia (4):91-126.
Kelvin, W.T. 1862 On the mechanical energies of the solar system. Plil. Mag., Ser 4, 8:409-430.
Kelvin, W.T. 1897 The age of the Earth as na abode fitted for life. Joirnal of the Victória Institute 31:11-15.
Krough, T.E. e Hurley, P.M. 1968 Strontium isotope variation and whole-rock isochron studies, Grenville Province, Ontário. Journal of Geophysical Research 73:7107-7125.
Long. L.E. 1966 Isotope dilution analysis of common and radiogenic strontium using 84Sr-enriched spike. Eath and Planetary Science Letters 1:289-292. .
Lyell, C. Principle of the Geology 1830
McDowell, C.A. 1963 Mass spevtrometry. McGraw-Hill, New York.
Nier, A. O. 1940 A mas spectrometer for routine isotope abundance measurements. Ver. Sci. Instrum., 11:212-216.
Powel, R. Woodhead, J. e Hergt, J. 1998 Uncertains onlead isotope analysis: deconvolution in the doublé-spike method. Chemical Geology 148:95-104.
Richards T.W. e Lembert, M.E. 1914 The atomic weight of lead of radioactive origin. Journal of the Amrican Chemical Society, 36:1329-1344.
Russel, R.D. 1971 The systematics of doublé spiking. Jurnal of Geophysical Research 76:4949-4955.
Russel, R.D. 1977 A solution in closed form for the isotopic dilution analysis of strontiun. Chemical Geology 20:307-314.
Rutheford, E. 1899 Uranium radiation and the electrical conduction produced by it. Philosophical Magazine, 47:109-163.
Rutheford, E. 1905 Present problem in radio-activity. Popular Science Monthly, 67:5-34.
Rutheford, E. 1906 Radioactive Transformations. Silliman Lectures, Yale, 1905. Yale University Press, New haven, 287p.
Soddy, F. 1913 The radio-elements and the periodic law. The Chemical News, 107:97-99.
Thirlwall, M.F. 2000 Inter-laboratory and other errors in Pb isotope analysis investigated using a 207Pb-204Pb double spike. Chemical Geology 163:299-322.
Thompson J.J. 1905 Emission of negative corpuscles by alkali metals. Philosophical Magazine, 10:584-590.
Wasserburg, G.J., Papanastassiou, D.A., Nenow, E.V. e Baum, C.A. 1969 A programable magnetic field mass spectrometer with on-line data processing. Ver. Sci. Instrum., 40:288-295.
Wasserburg, G.J., Jacobsen, S.B., DePaolo, D.J., McCulloch, M.T. e Wen, T. 1981 Precise determination of Sm/Nd ratios, Sm and Nd isotopic abundances in standart solutions. Geochemical and Cosmochimica Acta 45:2311-2323.
Weichert, D.H., Russel, R.D. e Blenkinsop, J. 1967 A method for digital recording for mass spectra. Canadian Journal of Physics 45:2609-2619.
Willians, H.S. 1893 The elements of the Geological Time-scale. Journal of Geology 1:283-295.

